Terapias
Terapia Génica
Sin duda la mejor alternativa de las posibles, pero probablemente la mas compleja de todas ellas. Ataca directamente la raíz del problema mediante la transferencia de genes para corregir la deficiencia en el ADN. El principal problema de esta terapia es conseguir insertar el gen bueno en las células que contienen el gen defectuoso. Para que la terapia génica funcione se debe entregar el gen bueno en cientos de millones de células, y para ello es necesario un vehículo o vector que trasporte el gen hasta el interior de la célula.
Puede utilizarse distintos tipos de vectores, como virus, retrovirus, adenovirus o virus adenoasociados. Estos últimos son los empleados, hasta el momento, en el desarrollo de las terapias génicas para Sanfilippo.
Un buen vector al menos debe:
• Ser reproducible y estable
• Permitir la inserción de material genético sin límite de tamaño.
• Reconocer y actuar sobre células específicas.
• Poder regular la expresión del gen terapéutico.
• Carecer de elementos que induzcan una respuesta inmune.
• Ser inocuo o que sus posibles efectos secundarios sean mínimos.
• Ser fácil de producir, almacenar y a un coste razonable
Una de las ventajas del uso de virus adenoasociados, AAV, es que son virus no patógenos y por lo tanto en la mayoría de los pacientes no aparecen respuestas inmunes para eliminar el virus ó las células tratadas. En contrapartida, tiene limitación en el tamaño del DNA recombinante que podemos usar dado el tamaño de estos virus y en la complejidad de su producción.
En septiembre de 1990, los Doctores Blaese, Anderson y sus colaboradores realizaron el primer ensayo clínico de terapia génica con resultado exitoso. La paciente era una niña de 4 años con deficiencia en adenosina desaminasa, una enfermedad recesiva muy rara que provoca una inmunodeficiencia combinada grave. El tratamiento consistió en introducir el gen ADA en linfocitos T cultivados, extraídos de la paciente y reintegrarlos posteriormente a su organismo. Dado que los linfocitos no son células madre y tienen una duración temporal limitada se sabía que, aún en el caso de que el ensayo tuviese éxito, la curación no sería definitiva por lo que tendría que ser repetida a intervalos regulares. Aunque los resultados fueron positivos y la niña pudo llevar desde entonces una vida normal, el tratamiento hubo de ser repetido, primero cada 1-2 meses y posteriormente cada 3-6 meses.
Terapia de Reemplazo Enzimático
La terapia de remplazo enzimático, ERT por sus siglas en inglés Enzymatic Replace Therapy, consiste en suministrar al paciente la proteína éxogena que en su organismo está siendo sintetizada de forma anormal. La proteína puede provenir de tejidos y fluidos humanos, ser sintetizada en bacterias, células de mamífero o levaduras, a las cuales se les ha introducido el gen correspondiente.
Actualmente son tratadas con ERT enfermedades como Gaucher, Fabry, Pompe, MPSI, MPSII y MPSVI. Shire, Genzyme y Biomarin son suministradores de este tipo de tratamiento.
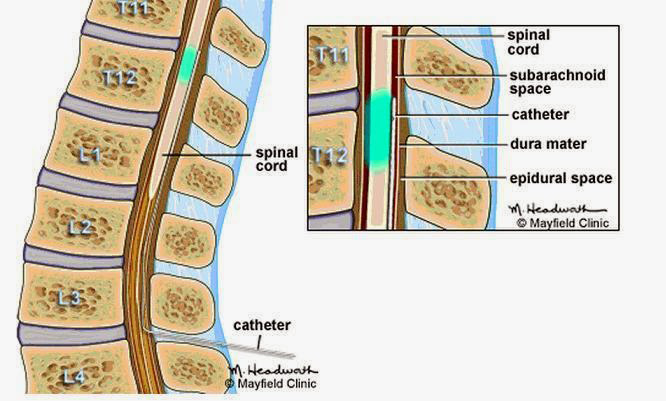
El Reemplazo Enzimático se aplica desde la década de los 90 en la enfermedad de Gaucher, y es lógico preguntarse cuál es la razón por la que sanfilippo aún no dispone de un tratamiento de este tipo. La respuesta se llama Barrera Hematoencefálica, en inglés Blood Brain Barrier y abreviada como BBB. La enzima suministrada por vía intravenosa no es capaz de atravesar esta barrera, y para la enfermedad de Sanfilippo es imprescindible, puesto que el mayor daño se produce en el cerebro.
Por fortuna, los investigadores han encontrado una forma de atravesar esta barrera, mejor dicho, de saltársela, entregando la encima en el interior del perímetro formado por la Barrera Hematoencefálica, a través de un catéter central interno implantado quirúrgicamente en el tejido subcutáneo en la médula espinal, a través del cual la encima accede al líquido cefalorraquídeo.
Esta técnica es de reciente aparición y aún es pronto para saber cuál será su efectividad. Shire Pharmaceuticals comenzó el primer ensayo clínico para Sanfilippo con Reemplazo Enzimático, por vía intratecal en Manchester y Ámsterdam en Septiembre de 2010.
Chaperonas
Las chaperonas son proteínas que favorecen la función de otras proteínas, por ejemplo, ayudando a su plegamiento. Una proteína está compuesta por la unión de varios aminoácidos, formando una cadena larga que se pliega en una determinada forma tridimensional. El plegamiento correcto es muy importante, puesto que en caso contrario la proteína no será funcional y será desechada.
Los aminoácidos tienen diferentes cargas eléctricas, de modo que se atraen o repelen para dar forma a la proteína. La existencia de una mutación puede hacer que se genere un aminoácido con diferente carga eléctrica, afectando a la forma final de la proteína, y pudiendo hacer que esta no sea funcional.
Las chaperonas van a ayudar a que la cadena de aminoácidos que tengamos (sana o alterada) vaya a plegarse mejor en el espacio y por lo tanto vaya a ser lo más funcional posible. Sin embargo, dependiendo de la mutación y del tipo de cadena de aminoácidos que tengamos, la chaperona puede ser útil ó puede no serlo.
Esta terapia está dirigida a mutaciones del tipo misense, donde la cadena de aminoácidos se forma completa, aunque sea de forma incorrecta, dando lugar a una proteína no funcional. En mutaciones nonsense, con señal de parada, la cadena formada es más corta de lo normal, por lo que las chaperonas no tendrían el efecto deseado.
En la web de Amicus Therapeutics puedes ver un video donde aparece una animación explicando el funcionamiento de las chaperonas. Está en inglés, pero la animación es muy didáctica y clara.
Inhibidores de Sustrato
En el año 2006, el Profesor Grzegorz Wegrzyn, Jefe del Departamento de Biología Molecular de la Universidad de Gdansk en Polonia, publicó un artículo sobre la Genisteína y su posible acción terapéutica para el Síndrome de Sanfilippo, al actuar ésta como inhibidor de Heparán Sulfato “Genistein-mediated inhibition of glycosaminoglycan synthesis as a basis for gene expression-targeted isoflavone therapy for mucopolysaccharidoses”.
La genisteína es una de las 230 isoflavonas de soja existentes, y junto con la daidzeína y la gliciteína son las de mayor interés terapéutico. Existen numerosos estudios relacionados con su posible beneficio en enfermedades cardíacas, Cáncer de Mama y de Próstata, Osteoporosis o Hipotiroidismo.
Desde que el Profesor Wegrzyn publicase este estudio han sido varios los ensayos clínicos llevados a cabo en diferentes países, entre ellos España, aunque desgraciadamente ninguno de ellos ha mostrado evidencias clínicas suficientes como para proponer a la genisteína como el primer tratamiento para el Síndrome de Sanfilippo. A pesar de ello, son muchos los padres que han mantenido y mantienen que la genisteína tiene un efecto terapéutico sobre sus hijos, y quizás esta haya sido la razón por la que, a pesar de la falta de evidencias clínicas concluyentes, se sigan desarrollando estudios sobre ella.
Los ensayos clínicos en humanos se han realizado con dosis de entre 5 y 10mg/kg y siempre con la forma natural de la molécula. Hoy en día disponemos de la forma sintética, fabricada por los laboratorios DSM y comercializada con el nombre de Bonistein, lo que ha propiciado que los investigadores estudien como alternativa terapéutica el uso de altas dosis de genisteína a partir de 100mg/kg.
La forma pura de la genisteína solo es posible adquirirla en EEUU a través de la Compañía Fallon Wellness Pharmacy.
Optimización de Sustrato
Zacharon es el primer laboratorio en desarrollar una terapia basada en este concepto. El objetivo es desarrollar una pequeña molécula con gran capacidad de penetración en el Sistema Nervioso Central, y que ésta sea capaz de actuar sobre la biosíntesis de los GAG’s implicados en el desarrollo de la enfermedad, Heparan Sulfato, de modo que éste pueda ser degradado a pesar de la deficiencia enzimática.
Los primeros intentos para identificar moléculas capaces de inhibir la biosíntesis de Heparán Sulfato no tuvieron éxito, de modo que Zacharon desarrollo un mecanismo de ensayo celular capaz de identificar inhibidores de cualquiera de los más de 20 enzimas necesarios para formar Heparán Sulfato. Usando es método testearon 74.000 compuestos, de los que se identificaron 264 como posibles candidatos. Finalmente, 30 de ellos fueron capaces de alterar la composición de Heparán Sulfato, y 15 de ellos se seleccionaron para desarrollar posibles variaciones sintéticas con el objetivo de optimizar su eficacia, potenciar la penetración de la Barrera Hematoencefálica, y presentarlo a la FDA (Food and Drug Administration) como IND (Investigational New Drug) para su aprobación y aplicación en ensayos clínicos.
